Retinale Ischämie
Die Retina weist einen hohen metabolischen Bedarf auf und reagiert daher sehr sensibel auf eine verminderte Durchblutung (Ischämie). Daher spielen ischämische Prozesse eine wichtige Rolle in der Pathophysiologie diverser Augenerkrankungen. Zu diesen zählen unter anderem das Glaukom, okuläre Gefäßverschlüsse sowie diabetische Retinopathien. Die therapeutischen Möglichkeiten sind zurzeit noch limitiert und bedürfen Analysen.
Eine Ischämie in der Retina führt zu einer Sauerstoffunterversorgung des Gewebes, wodurch es zu Zelltod sowie zu funktionellen und morphologischen Veränderungen kommt. Bei der anschließenden Wiederdurchblutung des Gewebes (Reperfusion) kommt es durch den vermehrt vorhandenen Sauerstoff und damit einhergehende aggressive Sauerstoff-Stoffwechselprodukte zusätzlich zu toxischen Wirkungen auf die neuronalen Zellen.
Ischämie/Reperfusions-Modell (I/R-Modell)
Anhand des I/R-Modell untersucht unsere Arbeitsgruppe die Auswirkung ischämischer Prozesse auf Retina und Sehnerv und versucht die molekularen Mechanismen dahinter zu entschlüsseln.
Dazu analysierten wir den Einfluss ischämischer Prozesse im zeitlichen Verlauf (2, 6, 12 und 24 Stunden, 3 und 7 Tage). Dabei konnten wir zeigen, dass es bereits 2 Stunden nach I/R zu einem signifikanten Verlust retinaler Ganglienzellen kommt. Der Schaden nimmt im weiteren Verlauf progredient zu und manifestiert sich in einer Verringerung der retinalen Schichtdicken sowie im Verlust neuronaler Zellen (Abbildung 1; Palmhof et al. 2019). Dabei sind insbesondere retinale Ganglienzellen, aber auch Amakrinzellen, Bipolarzellen und Photorezeptoren betroffen (Schmid et al. 2014, Palmhof et al. 2019). Zusätzlich nimmt auf Grund der starken Gewebeschäden die Anzahl inflammatorischer Mikrogliazellen zu und es kommt zu einem Funktionsverlust der inneren retinalen Zellschichten (Palmhof et al. 2019, Wagner et al. 2020).
Anhand unserer Analsyen von ischämischen Sehnerven war es uns möglich zu zeigen, dass es dort ebenfalls zu schweren Gewebeschäden in Form von Zellinfiltration, Demyelinisierung und Immigration und Aktivierung von Immuneffektorzellen kommt (Palmhof et al. 2020).
Untersuchungen zu den zugrundeliegenden Zelltodmechanismus zeigte, dass Apoptose (Schmid et al. 2014, Wagner et al. 2021)und Autophagie (Palmhof et al. 2018) involviert sind.
Abbildung 1: Zeitlicher Verlauf des Verlusts retinaler Ganglienzellen nach Ischämie.
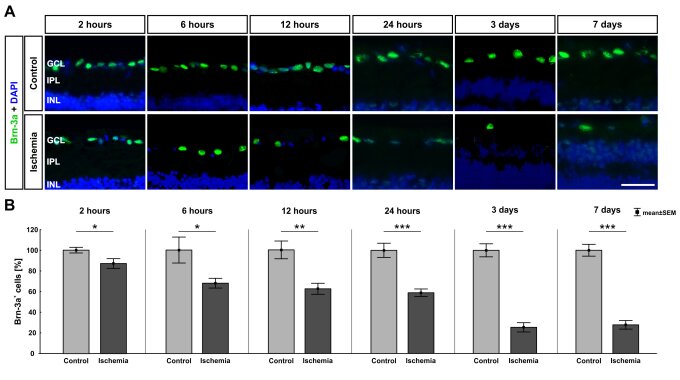
(A) Retinale Ganglienzellen wurden mit Brn-3a (grün) visualisiert, Zellkerne mit DAPI (blau). (B) Bereits 2 Stunden nach der Ischämie war ein signifikanter Verlust retinaler Ganglienzellen festzustellen (p=0,032). Dieser Verlust nahm mit der Zeit zu (6 Stunden: p=0,026, 12 Stunden: p=0,002, 24 Stunden, 3 und 7 Tage: p<0,001). Abkürzungen: GCL=Ganglienzellschicht, IPL=innere plexiforme Schicht, INL=innere Körnerschicht. Maßstab: 20 μm; B: n=7-8/Gruppe, C: n=5/Gruppe; *: p<0,05; **: p<0,01; ***: p<0,001 (Palmhof et al. 2019).