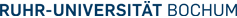Fluoreszenz
Fluoreszenz ist für die Untersuchung von Biomolekülen eine sehr empfindliche und vielseitig verwendete, spektroskopische Eigenschaft. Entweder werden intrinsische Fluorophore von Proteinen wie z. B. Tryptophane ausgenutzt oder es werden an bestimmte Seitenketten kleine, fluoreszierende Farbstoffe chemisch angeknüpft. Seit einigen Jahren dient auch das grün fluoreszierende Protein (GFP) dazu, andere Proteine zum Beispiel in einer lebenden Zelle oder in einem ganzen Organismus sichtbar zu machen. Wir nutzen diese genannten, verschiedenen Möglichkeiten, um die Interaktion von Proteinen quantitativ zu bestimmen – und zwar bezüglich ihrer Affinität (Spezifität) wie auch der Assoziations- und Dissziationsgeschwindigkeiten. Dazu verwenden wir konventionelle Fluoreszenz-Spektrometer beziehungsweise die stopped flow Technik. Eine besonders interessante Methode stellt für unsere Untersuchungen der Fluoreszenz-Energietransfer (FRET) dar, der zusätzlich zur Bindung zweier Biomoleküle auch noch Informationen über den Abstand bestimmter Teile (Domänen) innerhalb der Proteinkomplexe liefern kann.
Links: Die Abbildng zeigt eine typische Fluoreszenztitration, um die Affinität zwischen dem GTP-bindenden Protein hGBP1 und einem Nukleotid zu bestimmen. Die erhaltenen Daten erlauben eine genaue Berechnung der Gleichgewichtskonstanten.
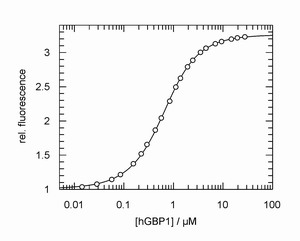
Rechts: Strukturformel von GTP mit der fluoreszierenden „mant“-Gruppe, die wir für unsere Studien häufig verwenden.
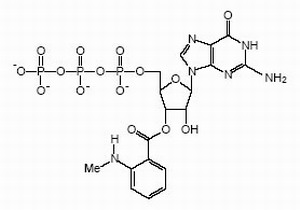
Schematische Illustration des Förster Resonanz Energietransfer (FRET). Zwei verschiedene Fluorophore werden jeweils an bestimmte Positionen in einem Protein (oder auf zwei verschiedenen) angebracht. Die spektroskopischen Eigenschaften sind derart gewählt, dass die Fluoreszenzanregung des einen Fluorophors (hier blau) zur Lichtemission des anderen (rot) führt, wobei dieser Effekt vom Abstand abhängig ist. Dadurch können wir nicht nur Informationen über Interaktionsgleichgewichte erhalten (s. o.), sondern auch über dynamische Prozesse und strukturelle Veränderungen.
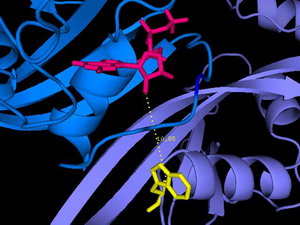
In diesem Ausschnitt aus der Röntgenstruktur des Ras/Nore Proteinkomplexes (entscheidend an der Regulation des programmierten Zelltods beteiligt) ist die räumliche Anordnung der Fluorophore (Nukleotid oben, Tryptophan unten) zu sehen, deren FRET die Interaktion von Ras und Nore wie auch den Abstand im Komplex quantitativ analysieren lässt.