Biochemische Methoden
Damit wir die Wechselwirkungen der uns interessierenden Proteine untersuchen können, müssen wir diese zunächst einmal herstellen und reinigen. Mit Hilfe eines geeigneten Expressionsvektors wird das jeweilige Protein in Bakterienkulturen synthetisiert und dann mit verschiedenen chromatographischen Methoden in zwei oder drei Schritten aufgereinigt. Molekularbiologische Standardmethoden (insbesondere PCR, polymerase chain reaction) erlauben die Konstruktion gewünschter Varianten der Proteine. Vor allem die Einführung bestimmter Punktmutationen oder die Deletion einer oder mehrerer Proteindomänen, gefolgt von den biophysikalischen Untersuchungen der veränderten Eigenschaften und der Vergleich mit dem Wildtyp erlauben aussagekräftige Rückschlüsse auf die Funktionsweise der Proteine.
Proteinaufreinigung
SDS-PAGE
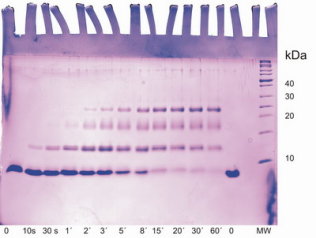
Die isolierten Proteine werden durch Gel-Elektrophorese auf ihre Reinheit überprüft. In dieser Abbildung ist die Analyse einer chemischen Cross-link Kinetik auf einem SDS-Polyacrylamid-Gel gezeigt. Ein Fragment der MST1-Kinase (Monomer unten) wird mit der Zeit (von links nach rechts) zunehmend zu Tetrameren (oben) verknüpft, zwischenzeitlich sind auch Dimere und Trimere zu erkennen.
Konzentrationsbestimmung mittels UV/Vis-Spektroskopie

Das A und O einer quantitativen Analyse von Protein-Wechselwirkungen ist eine genaue Bestimmung der Konzentrationen der beteiligten Interaktionspartner. Mit Hilfe der UV/Vis-Spektroskopie (Bild) wenden wir verschiedene Methoden an (Gill & von Hippel, Bradford etc).