Fakultät für
Chemie
und Biochemie
Biochemie II
Biomolekulare NMR-Spektroskopie
Prof. Dr. Raphael Stoll
Gebäude NC 5/171
Universitätsstraße 150
D-44780 Bochum
Tel.: +49 234 32-25466
Fax: +49 234 32-05466
E-Mail: bionmr@rub.de
Aktuelle Meldungen
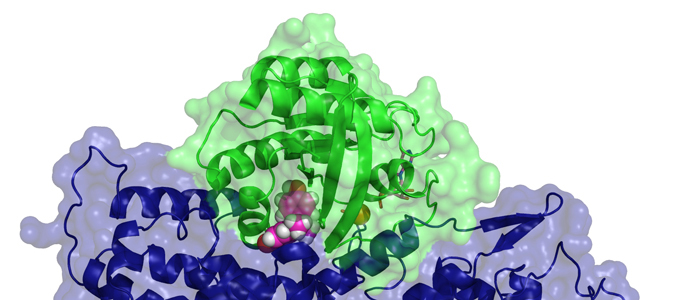
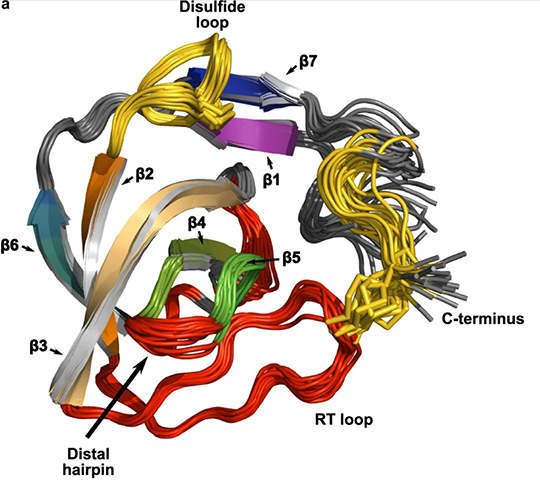 Die Entdeckung der MOTH-Domäne erlaubt Einblicke in die Evolution. Denn sowohl Insekten als auch Wirbeltiere benötigen Kollagen in ihrem Bindegewebe.
Kollagen ist das Protein, das unseren Körper zusammenhält. Produziert wird es innerhalb von Zellen, dann muss es an seinen Wirkungsort im Bindegewebe transportiert werden. Für die Erkennung des Kollagens ist eine Proteindomäne zuständig, die bislang als Unterform einer anderen verkannt wurde. Dr. Oliver Arnolds und Prof. Dr. Raphael Stoll aus der Fakultät für Chemie und Biochemie der Ruhr-Universität Bochum haben diese Domäne erstmals charakterisiert und getauft: Über die sogenannte MOTH-Domäne der TANGO1-Proteinfamilie berichten sie in der Zeitschrift Nature Communications vom 20. April 2023.
Die Entdeckung der MOTH-Domäne erlaubt Einblicke in die Evolution. Denn sowohl Insekten als auch Wirbeltiere benötigen Kollagen in ihrem Bindegewebe.
Kollagen ist das Protein, das unseren Körper zusammenhält. Produziert wird es innerhalb von Zellen, dann muss es an seinen Wirkungsort im Bindegewebe transportiert werden. Für die Erkennung des Kollagens ist eine Proteindomäne zuständig, die bislang als Unterform einer anderen verkannt wurde. Dr. Oliver Arnolds und Prof. Dr. Raphael Stoll aus der Fakultät für Chemie und Biochemie der Ruhr-Universität Bochum haben diese Domäne erstmals charakterisiert und getauft: Über die sogenannte MOTH-Domäne der TANGO1-Proteinfamilie berichten sie in der Zeitschrift Nature Communications vom 20. April 2023.
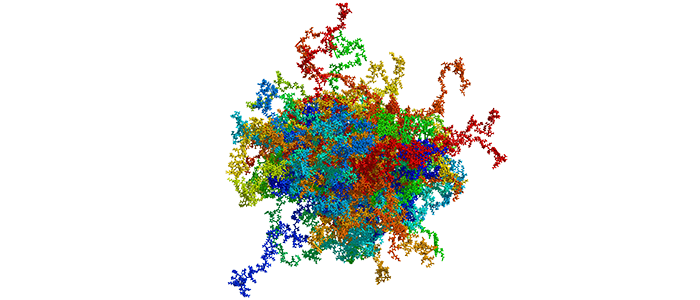
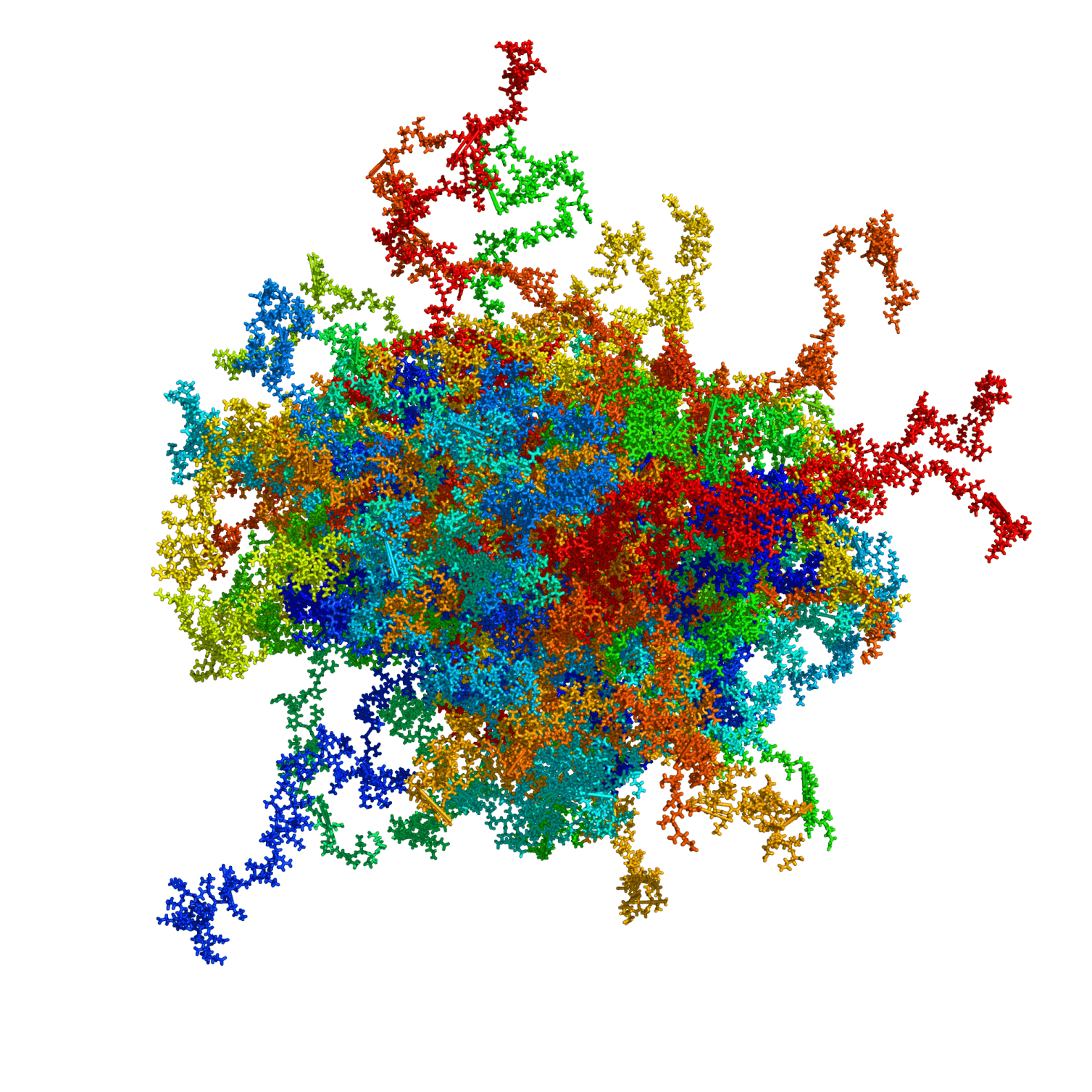 Während die korrekte Funktion vieler Proteine von ihrer dreidimensionalen Struktur abhängt, scheinen einige zufällige Formen anzunehmen. Für eines von ihnen hat ein Forscherteam der RUB gezeigt, dass die vermeintliche Unordnung gar keine ist: Das Protein HMGA1a nimmt dynamische, kompaktere Strukturen an, die von seiner Phosphorylierung abhängen. Eine Fehlfunktion von HMGA1a kann zu Krebserkrankungen führen. Die Forscher um Prof. Dr. Raphael Stoll erwarten daher, dass ihre Ergebnisse eine Grundlage für künftige therapeutische Strategien gegen Krebserkrankungen darstellen, die durch HMGA1a verursacht werden. Sie berichten im Journal Nucleic Acids Research vom 24. Juli 2019.
Während die korrekte Funktion vieler Proteine von ihrer dreidimensionalen Struktur abhängt, scheinen einige zufällige Formen anzunehmen. Für eines von ihnen hat ein Forscherteam der RUB gezeigt, dass die vermeintliche Unordnung gar keine ist: Das Protein HMGA1a nimmt dynamische, kompaktere Strukturen an, die von seiner Phosphorylierung abhängen. Eine Fehlfunktion von HMGA1a kann zu Krebserkrankungen führen. Die Forscher um Prof. Dr. Raphael Stoll erwarten daher, dass ihre Ergebnisse eine Grundlage für künftige therapeutische Strategien gegen Krebserkrankungen darstellen, die durch HMGA1a verursacht werden. Sie berichten im Journal Nucleic Acids Research vom 24. Juli 2019.
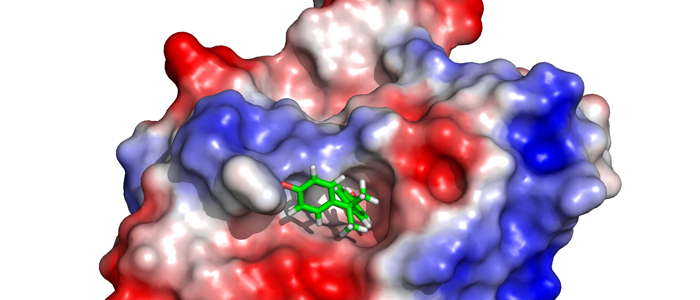
Viele – aber nicht alle – Proteine in einer lebenden Zelle haben eine definierte dreidimensionale Struktur, die für ihre korrekte Aktivität absolut notwendig ist. Die wechselseitige Beziehung zwischen Struktur und Funktion von Proteinen steht im Fokus vieler Forschungsinitiativen, die bis zur Entwicklung neuartiger Medikamente reichen.
Neuartige Wirkmechanismen von Naturstoffen sollen das Problem eindämmen.
Resistente Bakterien verbreiten sich und gefährden die Wirksamkeit von Antibiotika weltweit.
Forscherinnen und Forscher aus Wuppertal und Bochum wollen gemeinsam mit dem Dortmunder Lead Discovery Center neuartige Antibiotika entwickeln, die diese Resistenzen brechen.
Das Bundesministerium für Bildung und Forschung fördert das Vorhaben, das die Bergische Universität Wuppertal koordiniert, mit rund zwei Millionen Euro. Das Projekt ist am 1. April 2019 gestartet und läuft für dreieinhalb Jahre.
Das Projekt „Nanocombac“ – kurz für: „Naturstoff-Gold Nanocarrier-Konjugate, eine neuartige Dual-mode-Strategie zur Bekämpfung resistenter Bakterien“ – will antibakterielle Naturstoffe nutzen, um die Zellmembran resistenter Bakterien überwinden können. Die Substanzen verfügen über Wirkmechanismen, die kommerzielle Antibiotika bisher nicht adressieren. Ziel des Projektes ist es, den Weg für eine präklinische Validierung und eine zukünftige klinische Entwicklung zu ebnen.
Am Ende des Forschungsvorhabens soll ein Krebsmedikament für klinische Studien bereitstehen. Einen neuen Wirkstoff gegen Krebs wollen Forscherinnen und Forscher aus Essen, Bochum und Wuppertal entwickeln. Das Land NRW fördert das Vorhaben "RIST: RAS INHIBITION IN SOLIDEN TUMOREN" mit 1,7 Millionen Euro mit Mitteln aus dem Europäischen Fonds für regionale Entwicklung, kurz EFRE.

Meeting with contributions from former students of Prof. W. Voelter
 Nach zwölf Jahren Proteinforschung fassen die verantwortlichen Wissenschaftler ihre Hauptergebnisse zusammen. Damit füllen sie zwei Ausgaben einer Fachzeitschrift.
Nach zwölf Jahren Proteinforschung fassen die verantwortlichen Wissenschaftler ihre Hauptergebnisse zusammen. Damit füllen sie zwei Ausgaben einer Fachzeitschrift.
 Viele Krankheiten wie etwa Krebs entstehen aus fehlerhaftem Verhalten von Proteinen. Wie sie interagieren und was dabei falsch ablaufen kann, können Forscher nun besser verstehen.
Viele Krankheiten wie etwa Krebs entstehen aus fehlerhaftem Verhalten von Proteinen. Wie sie interagieren und was dabei falsch ablaufen kann, können Forscher nun besser verstehen.
Seit 2004 fördert die Deutsche Forschungsgemeinschaft mit über 26 Millionen Euro den Sonderforschungsbereich 642 „GTP- und ATP-abhängige Membranprozesse“ (Sprecher: Prof. Dr. Klaus Gerwert). In 23 Teilprojekten untersuchten Bochumer und Dortmunder Wissenschaftler Signalwege und Transportprozesse innerhalb von Zellen, konnten sie räumlich und zeitlich auf verschiedenen Skalen auflösen und besser verstehen.
 Wir gratulieren recht herzlich unserer Mitarbeiterin Saskia Körning zum Wilke-Preis für den besten Zweifach-Bachelor-Abschluss 2015 in Chemie.
Wir gratulieren recht herzlich unserer Mitarbeiterin Saskia Körning zum Wilke-Preis für den besten Zweifach-Bachelor-Abschluss 2015 in Chemie.
 Das Jahrestreffen des bio-N3MR Netzwerkes fand 2015 erstmals an der Ruhr-Universität Bochum statt. Nachwuchswissenschaftler der beteiligten Gruppen stellten ihre aktuellen Forschungsprojekte während eines Symposiums in Hörsaal HNC10 und der anschließenden Postersitzung vor. Nach der Mittagspause besuchten die Teilnehmer des bio-N3MR Jahrestreffens die NMR Vorträge der zeitgleich an der Ruhr-Universität stattfindenden „European Conference on the Spectroscopy of Biological Molecules".
Das Jahrestreffen des bio-N3MR Netzwerkes fand 2015 erstmals an der Ruhr-Universität Bochum statt. Nachwuchswissenschaftler der beteiligten Gruppen stellten ihre aktuellen Forschungsprojekte während eines Symposiums in Hörsaal HNC10 und der anschließenden Postersitzung vor. Nach der Mittagspause besuchten die Teilnehmer des bio-N3MR Jahrestreffens die NMR Vorträge der zeitgleich an der Ruhr-Universität stattfindenden „European Conference on the Spectroscopy of Biological Molecules".
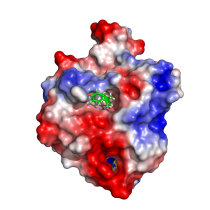 Funktion und Regeneration von Schalterproteinen gestört.
Bochumer und Wuppertaler Forscher untersuchen Effekte auf Enzyme.
Bisphenol A stört die Funktion von Proteinen, die entscheidend für Wachstumsprozesse in Zellen sind. Das berichten Forscher der Ruhr-Universität Bochum und der Bergischen Universität Wuppertal. Die Substanz, kurz BPA, kommt in vielen Kunststoffprodukten vor und steht im Verdacht, gesundheitsschädlich zu sein. Bisher ging man davon aus, dass Bisphenol A an Hormonrezeptoren bindet und dadurch seine schädliche Wirkung entfaltet. Das Team von Chemikern und Biochemikern entdeckte, dass die Substanz auch auf die sogenannten kleinen GTPasen wirkt. Die Ergebnisse sind im „Journal of Medicinal Chemistry” veröffentlicht.
Funktion und Regeneration von Schalterproteinen gestört.
Bochumer und Wuppertaler Forscher untersuchen Effekte auf Enzyme.
Bisphenol A stört die Funktion von Proteinen, die entscheidend für Wachstumsprozesse in Zellen sind. Das berichten Forscher der Ruhr-Universität Bochum und der Bergischen Universität Wuppertal. Die Substanz, kurz BPA, kommt in vielen Kunststoffprodukten vor und steht im Verdacht, gesundheitsschädlich zu sein. Bisher ging man davon aus, dass Bisphenol A an Hormonrezeptoren bindet und dadurch seine schädliche Wirkung entfaltet. Das Team von Chemikern und Biochemikern entdeckte, dass die Substanz auch auf die sogenannten kleinen GTPasen wirkt. Die Ergebnisse sind im „Journal of Medicinal Chemistry” veröffentlicht.
 |
Wir gratulieren recht herzlich unserer Mitarbeiterin Miriam Schöpel zum GBM-Preis 2013 der "Gesellschaft für Biochemie und Molekularbiologie e.V." für die beste Masterarbeit im Studiengang Biochemie.
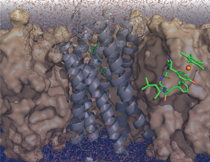 RUB-Forscher entschlüsseln Zusammenspiel von Enkephalinen und Schmerzrezeptoren
Metallkomplex macht flüchtigen Botenstoff dingfest
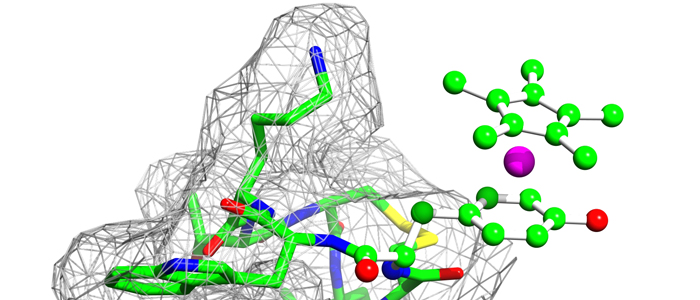
„Schmerz lass nach!“ Um dieses Signal zu senden, produziert der menschliche Körper kleine Botenstoffmoleküle, die an bestimmte Rezeptoren andocken. Dieses Zusammenspiel zwischen den Botenstoffen, Enkephaline genannt, und Opioidrezeptoren ist mit herkömmlichen biochemischen Methoden schwer zu untersuchen. Einem interdisziplinären Team von Biochemikern und Anorganischen Chemikern der Ruhr-Universität Bochum (RUB) gelang es nun, die Struktur eines Enkephalins in Lösung zu bestimmen und erstmals seine Interaktion mit dem Opioidrezeptor im Detail zu verfolgen. Die Analyse liefert präzise neue Ansatzpunkte für die Entwicklung von Medikamenten, die gezielt bestimmte Arten von Schmerz bekämpfen. Die Zeitschrift „Dalton Transactions“ widmet dem Thema die Titelgeschichte.
RUB-Forscher entschlüsseln Zusammenspiel von Enkephalinen und Schmerzrezeptoren
Metallkomplex macht flüchtigen Botenstoff dingfest
„Schmerz lass nach!“ Um dieses Signal zu senden, produziert der menschliche Körper kleine Botenstoffmoleküle, die an bestimmte Rezeptoren andocken. Dieses Zusammenspiel zwischen den Botenstoffen, Enkephaline genannt, und Opioidrezeptoren ist mit herkömmlichen biochemischen Methoden schwer zu untersuchen. Einem interdisziplinären Team von Biochemikern und Anorganischen Chemikern der Ruhr-Universität Bochum (RUB) gelang es nun, die Struktur eines Enkephalins in Lösung zu bestimmen und erstmals seine Interaktion mit dem Opioidrezeptor im Detail zu verfolgen. Die Analyse liefert präzise neue Ansatzpunkte für die Entwicklung von Medikamenten, die gezielt bestimmte Arten von Schmerz bekämpfen. Die Zeitschrift „Dalton Transactions“ widmet dem Thema die Titelgeschichte.
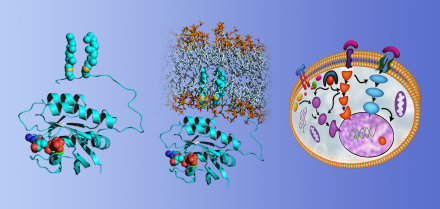
Das Protein Ras in Lösung, an der Membran und in der Signaltrans-
duktionskaskade innerhalb der lebenden Zelle (von links nach rechts).
Die RUB, die TU Dortmund und das Dortmunder MPI freuen sich über die Verlängerung des Sonderforschungsbereichs 642 (Sprecher: Prof. Klaus Gerwert, RUB) um weitere 3,5 Jahre. Von der Struktur- bis zur Systembiologie, von der Biophysik über die chemische Biologie bis hin zur Zellbiologie arbeiten Wissenschaftler aus Bochum und Dortmund fachübergreifend in der Proteinforschung zusammen.
Mit der nun bewilligten weiteren Förderung von 7,2 Mio. Euro wurden über die volle Laufzeit von insgesamt zwölf Jahren rund 20,3 Mio. Euro eingeworben. Insgesamt sind 17 Projekte aus den Bochumer Fakultäten für Biologie, Chemie und Medizin sowie der Technischen Universität und dem Max Planck Institut für molekulare Physiologie in Dortmund am bereits 2004 gegründeten SFB 642 „GTP- und ATP-abhängige Membranprozesse“ beteiligt.
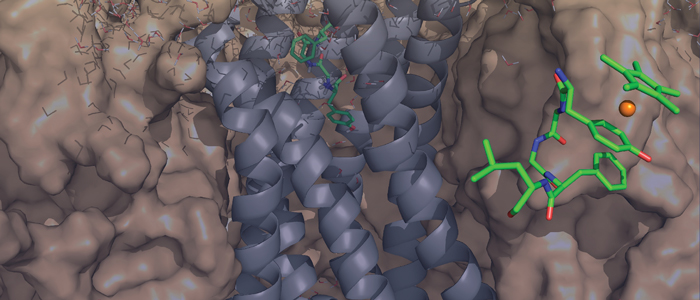
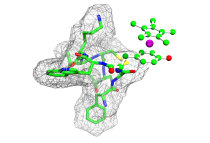 Forscher der RUB und aus Berkeley haben aus Aminosäuren bestehende Hormone durch Metallkomplexe modifiziert. In der Zeitschrift Journal of the American Chemical Society berichten sie erstmals auch die dreidimensionale Struktur der dabei entstehenden Metall-Peptid-Verbindungen.
Hormone chemisch modifizieren
Forscher der RUB und aus Berkeley haben aus Aminosäuren bestehende Hormone durch Metallkomplexe modifiziert. In der Zeitschrift Journal of the American Chemical Society berichten sie erstmals auch die dreidimensionale Struktur der dabei entstehenden Metall-Peptid-Verbindungen.
Hormone chemisch modifizieren
Die Hormone lassen sich gezielt chemisch modifizieren, so dass sich ihre Wirkung ändert, beispielsweise das Schmerzempfinden verringert oder das Tumorwachstum hemmt. „Damit legen wir die molekulare Grundlage für die Entwicklung besserer Medikamente“, sagt Prof. Raphael Stoll von der Fakultät für Chemie und Biochemie der Ruhr-Universität. Das Team untersuchte Hormone, die Schmerzwahrnehmung und Tumorwachstum beeinflussen.
 Einladung zur 34. GDCh-Diskussionstagung
Einladung zur 34. GDCh-Diskussionstagung
"Praktische Probleme der Kernresonanz-
spektroskopie"
14. - 15. Januar 2013 in Erlangen.
Die Teilnahme ist wie immer gebührenfrei.
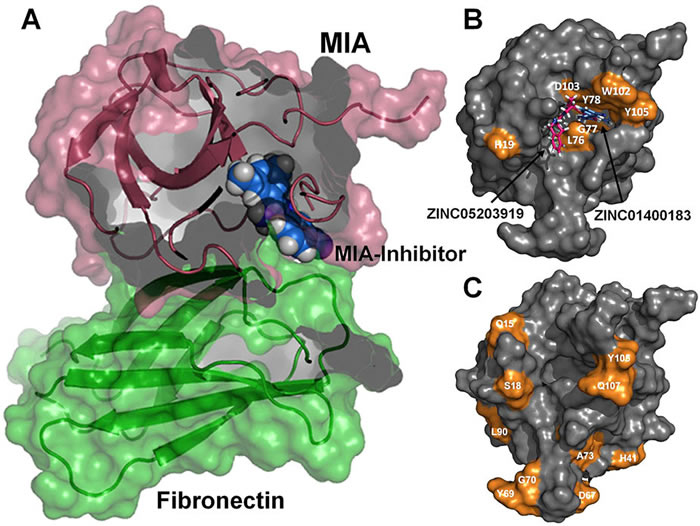
 Mutierte Proteine ausschalten und so bösartige Tumore bekämpfen – das ist das Ziel des neuen Gemeinschaftsprojektes von Wuppertaler und Bochumer Forschern. Zu diesem Zweck kooperiert die RUB-Arbeitsgruppe Biomolekulare NMR-Spektroskopie von Prof. Dr. Raphael Stoll mit der Wuppertaler Arbeitsgruppe Bioorganische Chemie unter Leitung von Prof. Dr. Jürgen Scherkenbeck. Die Deutsche Krebshilfe fördert das Vorhaben zwei Jahre lang mit 200.000 Euro.
Mutierte Proteine ausschalten und so bösartige Tumore bekämpfen – das ist das Ziel des neuen Gemeinschaftsprojektes von Wuppertaler und Bochumer Forschern. Zu diesem Zweck kooperiert die RUB-Arbeitsgruppe Biomolekulare NMR-Spektroskopie von Prof. Dr. Raphael Stoll mit der Wuppertaler Arbeitsgruppe Bioorganische Chemie unter Leitung von Prof. Dr. Jürgen Scherkenbeck. Die Deutsche Krebshilfe fördert das Vorhaben zwei Jahre lang mit 200.000 Euro.
 Tag der offenen Tür im Alfried Krupp-Schülerlabor am 24.09.2011
Tag der offenen Tür im Alfried Krupp-Schülerlabor am 24.09.2011
Tag der offenen Tür für alle Neugierigen - Entdecken & Begreifen von MINT und Geisteswissenschaften
Am 24.09.2011 von 10.00 bis 15.00 Uhr öffnet das Schülerlabor seine Türen und heißt alle Neugierigen willkommen! Bei uns gilt: mitmachen - forschend lernen - an einem spannenden Ort auf kluge Weise experimentieren. Wir sind eines der vielfältigsten Schülerlabore in ganz Deutschland, und am Tag der offenen Tür zeigen wir Experimente und Materialien aus unseren Projekten zum Anfassen und selber Ausprobieren.
 Zwei junge Krebsforscher der Ruhr-Universität können sich über Unterstützung bei ihren Dissertationsprojekten freuen: King Tuo Yip (Biochemie, Betreuer: Prof. Dr. Raphael Stoll) und Swetlana Ladigan (Pathologie, Betreuer: Dr. Alireza Mirmohammadsadegh) wurden bei der diesjährigen FoRUM-Tagung der Medizinischen Fakultät der RUB mit den Stipendien der Schäfersnolte-Gedächtnis-Stiftung ausgezeichnet und erhalten für ein Jahr monatlich 1.200 Euro Förderung. Im Mittelpunkt ihrer Arbeiten stehen detaillierte Untersuchungen zur Entwicklung von Darmkrebs und zur Bildung von Metastasen beim schwarzen Hautkrebs.
Zwei junge Krebsforscher der Ruhr-Universität können sich über Unterstützung bei ihren Dissertationsprojekten freuen: King Tuo Yip (Biochemie, Betreuer: Prof. Dr. Raphael Stoll) und Swetlana Ladigan (Pathologie, Betreuer: Dr. Alireza Mirmohammadsadegh) wurden bei der diesjährigen FoRUM-Tagung der Medizinischen Fakultät der RUB mit den Stipendien der Schäfersnolte-Gedächtnis-Stiftung ausgezeichnet und erhalten für ein Jahr monatlich 1.200 Euro Förderung. Im Mittelpunkt ihrer Arbeiten stehen detaillierte Untersuchungen zur Entwicklung von Darmkrebs und zur Bildung von Metastasen beim schwarzen Hautkrebs.
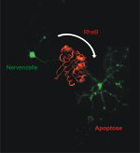 Das Signalprotein Rheb kommt in vielen Körperzellen, besonders im Gehirn vor. Es ist wichtig für Wachstumsprozesse – bei Zellstress zeigt es aber sein zweites Gesicht. In diesem Fall beschleunigt es den Tod der Zelle. Diese Erkenntnis haben Forscher um Prof. Dr. Rolf Heumann und Prof. Dr. Raphael Stoll von der Ruhr-Universität Bochum gewonnen.
Sie hat Auswirkungen auf die Behandlung von Erkrankungen: Das verbreitet eingesetzte Antibiotikum Rapamycin, das die Signalweiterleitung von Rheb verhindert, sollte mit Bedacht eingesetzt werden, raten die Forscher. Unter Zellstressbedingungen könnte sich seine Wirkung umkehren. Die Forscher berichten im Journal of Biological Chemistry.
Das Signalprotein Rheb kommt in vielen Körperzellen, besonders im Gehirn vor. Es ist wichtig für Wachstumsprozesse – bei Zellstress zeigt es aber sein zweites Gesicht. In diesem Fall beschleunigt es den Tod der Zelle. Diese Erkenntnis haben Forscher um Prof. Dr. Rolf Heumann und Prof. Dr. Raphael Stoll von der Ruhr-Universität Bochum gewonnen.
Sie hat Auswirkungen auf die Behandlung von Erkrankungen: Das verbreitet eingesetzte Antibiotikum Rapamycin, das die Signalweiterleitung von Rheb verhindert, sollte mit Bedacht eingesetzt werden, raten die Forscher. Unter Zellstressbedingungen könnte sich seine Wirkung umkehren. Die Forscher berichten im Journal of Biological Chemistry.
 Es geht erfolgreich weiter mit der Proteinforschung an der RUB: der SFB 642 (GTP und ATP abhängige Membranprozesse, Sprecher Klaus Gerwert) wird für weitere vier Jahre bis 2012 gefördert. Nach vier Jahren kooperativer Forschung von 2004-2008 ist der SFB bei der internationalen zweitätigen Begutachtung am 9./10. April in Bochum „als exzellentes, international sichtbareres Cluster“ bewertet und das Fördervolumen nach einer strengen Prüfung durch den Bewilligungsausschuss der DFG am 20. Mai von 6 auf 9,6 Millionen Euro aufstockt worden. Zusätzlich wurden 12 Doktoranden Stipendien für eine SFB interne Graduierten-Ausbildung zur Förderung des wissenschaftlichen Nachwuchses bewilligt.
Es geht erfolgreich weiter mit der Proteinforschung an der RUB: der SFB 642 (GTP und ATP abhängige Membranprozesse, Sprecher Klaus Gerwert) wird für weitere vier Jahre bis 2012 gefördert. Nach vier Jahren kooperativer Forschung von 2004-2008 ist der SFB bei der internationalen zweitätigen Begutachtung am 9./10. April in Bochum „als exzellentes, international sichtbareres Cluster“ bewertet und das Fördervolumen nach einer strengen Prüfung durch den Bewilligungsausschuss der DFG am 20. Mai von 6 auf 9,6 Millionen Euro aufstockt worden. Zusätzlich wurden 12 Doktoranden Stipendien für eine SFB interne Graduierten-Ausbildung zur Förderung des wissenschaftlichen Nachwuchses bewilligt.
 21.03.2007 - Ein Netzwerk für Biomolekulare Kernspintomographie (NMR) wurde mit Beteiligung des Forschungszentrums Jülich in Düsseldorf gegründet. Jülich verfügt neben seiner wissenschaftlichen Expertise über ein NMR-Zentrum mit drei leistungsstarken Spektrometern.
Das NRW-Netzwerk bio-N3MR wurde als eine Kooperation des Forschungszentrums Jülich, der Heinrich-Heine-Universität Düsseldorf, der Ruhr-Universität Bochum, der Universität Duisburg-Essen sowie dem Max-Planck-Institut für molekulare Physiologie in Dortmund im Bereich der NMR-basierten strukturbiologischen Forschung gegründet.
21.03.2007 - Ein Netzwerk für Biomolekulare Kernspintomographie (NMR) wurde mit Beteiligung des Forschungszentrums Jülich in Düsseldorf gegründet. Jülich verfügt neben seiner wissenschaftlichen Expertise über ein NMR-Zentrum mit drei leistungsstarken Spektrometern.
Das NRW-Netzwerk bio-N3MR wurde als eine Kooperation des Forschungszentrums Jülich, der Heinrich-Heine-Universität Düsseldorf, der Ruhr-Universität Bochum, der Universität Duisburg-Essen sowie dem Max-Planck-Institut für molekulare Physiologie in Dortmund im Bereich der NMR-basierten strukturbiologischen Forschung gegründet.
 Wir gratulieren recht herzlich unserem Mitarbeiter Gerd Kock zum Wilke-Preis 2007 des "Vereins zur Förderung der Chemie und Biochemie" an der Ruhr-Universität Bochum für den besten Abschluss im Studiengang Biochemie.
Wir gratulieren recht herzlich unserem Mitarbeiter Gerd Kock zum Wilke-Preis 2007 des "Vereins zur Förderung der Chemie und Biochemie" an der Ruhr-Universität Bochum für den besten Abschluss im Studiengang Biochemie.