Aktuelles
Zusammenarbeit mit der Arbeitsgruppe von Dr. Martin Schwärzel der FU Berlin: Wenn Fliegen aufs Töpfen müssen – oder das ferngesteuerte Organ – Kurze Lichtblitze erzeugen zelluläre Signalstoffe, die Hormonwirkungen simulieren und so Kontrolle über die Funktion eines Organs erlangen können.
Separate roles of PKA and EPAC in renal function unraveled by the optogenetic control of cAMP levels in vivo
Marina Efetova, Linda Petereit, Kamil Rosiewicz, Gayle Overend, Florian Haußig, Bernhard T. Hovemann, Pablo Cabrero, Julian A. T. Dow and Martin Schwärzel
Journal of Cell Science, December 21, 2012 doi: 10.1242/jcs.114140
Die beta-Alanin Synthese durch Black ist in Drosophila mit Ebony am Ort der Histamin Neurotransmitter Inaktivierung co-exprimiert
Activity and co-expression of Drosophila Black with Ebony in fly optic lobes reveals putative cooperative tasks in vision that evade ERG detection.
Ziegler AB, Brüsselbach F, Hovemann BT.
J Comp Neurol. 2012 Nov 1. DOI: 10.1002/cne.23247 [Epub ahead of print]
Zusammenarbeit mit der Klinik für Neurologie des St. Josef-Hospitals Bochum: Angst und depressiv-ähnliches Verhalten
Endogenous ciliary neurotrophic factor modulates anxiety and depressive-like behavior.
Peruga I, Hartwig S, Merkler D, Thöne J, Hovemann B, Juckel G, Gold R, Linker RA.
Behav Brain Res. 2012 Apr 15;229(2):325-32. Epub 2012 Jan 17
Visuelle Signalübertragung bei Invertebraten am Beispiel Drosophila: Untersuchung eines neuartigen Neurotransmitter-Inaktivierungs- und Recyclingwegs
Wahrnehmung und Verarbeitung visueller und olfaktorischer Impulse steuert das Verhalten vieler Insekten und leistet dadurch einen essentiellen Beitrag zu ihrem Überleben. Zur Orientierung und zum Schutz vor Feinden ist ihr Organismus in der Lage schnell auf minimale Änderungen der Licht Intensität zu reagieren.
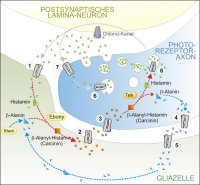
Der zugrunde liegende Prozess der Phototransduktion bei der Taufliege Drosophila melanogaster ist etwa zwanzig Mal schneller als beim Menschen und stellt die schnellste bekannte G-Protein gekoppelte Signalkaskade dar. Für eine hohe zeitliche Auflösung der Signal Wahrnehmung haben sich ebenso schnelle Mechanismen der Signal Termination und Adaptation entwickelt. Histamin wird als Neurotransmitter nach Depolarisation der Photorezeptor Zellen frei gesetzt. Es bindet an postsynaptische Neurone, die durch Histamin-gesteuerte Chlorid-Kanäle hyperpolarisiert werden. Damit kommt es zu einer Signalumkehr. Da die Histamin Freisetzung kontinuierlich erfolgt, wird das postsynaptische Signal durch Variation der Konzentration im synaptischen Spalt moduliert. Um eine zeitliche Auflösung des visuellen Signals gewährleisten zu können, muss Histamin mit adäquater Geschwindigkeit kontinuierlich aus dem Spalt entfernt werden. Wir verfolgen deshalb ein Modell, das eine schnelle Inaktivierung und Rückführung des Histamins in die Photorezeptor-Axone beinhaltet.
Danach wird Histamin aus dem synaptischen Spalt über einen Transporter in die benachbarte Glia aufgenommen und dort von dem Enzym Ebony in ß-Alanyl-Histamin (Carcinin) umgewandelt. ß-Alanin könnte aus dem Uracil-Abbauweg oder von der Aspartat Decarboxylase Black bereit gestellt werden. Carcinin wird dann aus der Glia entlassen und über einen weiteren Transporter in die Photorezeptorzelle aufgenommen. Dort hydrolysiert das Enzym Tan das Carcinin wieder in die Ausgangsbestandteile Histamin und ß-Alanin. Histamin wird in synaptische Vesikel transportiert und steht erneut als Neurotransmitter zur Verfügung. ß-Alanin kann entweder in den Energiestoffwechsel einfließen oder über einen Shuttle-Mechanismus in die Glia zurück transportiert werden. Der Fokus unserer Forschung liegt darauf, diesen neuartigen Inaktivierung/Recycling Weg zu beweisen. Wir befassen uns dazu mit den Enzymen Ebony, Tan und Black und versuchen die erforderlichen Transportsysteme zu identifizieren.