DFG-Forschergruppe 630
Biological function of organometallic compounds
ProjekteProf. Dr. Nils Metzler-Nolte (Universität Bochum - Sprecher)Organometall-Peptidkonjugate: Modulation der Cytotoxizität durch gezielte Veränderung von Aufnahme und zellulärer Lokalisierung
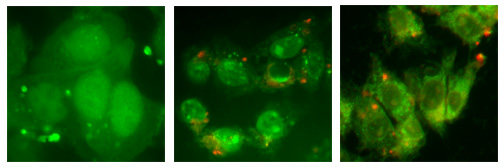
Abb.: Ein mit Ferrocen und Fluorescein doppelt markiertes Peptid und seine sub-zelluläre Verteilung (aufgenommen mit konfokaler Mikroskopie) Das Potential von Organometallverbindungen als neue Leitstrukturen gegen innovative Targets ist noch weitgehend unerforscht. In diesem Projekt untersuchen wir systematisch, ob und inwieweit sich die Cytotoxizität von Organometallverbindungen durch Veränderung der Aufnahme in Zellen und intrazelluläre Lokalisierung gezielt steuern lässt. Als Organometallkomplexe sind verschiedene Metallocene, Halbsandwichkomplexe und Metallcarbonyle ausgewählt. Zur Modulation der biologischen Eigenschaften werden diese Metallkomplexe kovalent an Peptiden gebunden. Hierbei werden etablierte Methoden der Festphasen-Peptidsynthese für die Anwendung von Organometallverbindungen weiterentwickelt. Die Aufnahme der Metallkomplexe in Zellen wird durch kleine kationische Peptide (z. B. Poly-Arg und Tat) erhöht. Ein tumorspezifisches Targeting wird durch solche Peptidsequenzen erreicht, für die bestimmte Tumorzelllinien Rezeptoren überexprimieren (z.B. Somatostatin und Octreotid). Die intrazelluläre Lokalisierung wird durch verschiedene NLS-Sequenzen gesteuert (NLS = nuclear localization sequence). Neben Untersuchungen zur Stabilität unter physiologischen Bedingungen werden die biochemischen Eigenschaften der Konjugate ermittelt werden. Die Aufnahme in Zellen und die zelluläre Verteilung wird durch Fluoreszenzmikroskopie und AAS verfolgt, die Cytotoxizität durch photometrische Assays bestimmt. Dr. Ines Neundorf / Prof. Dr. Annette Beck-Sickinger (Universität Leipzig)Markierung von Peptidhormonen mit Metallkomplexen für Tumordiagonstik und -therapie
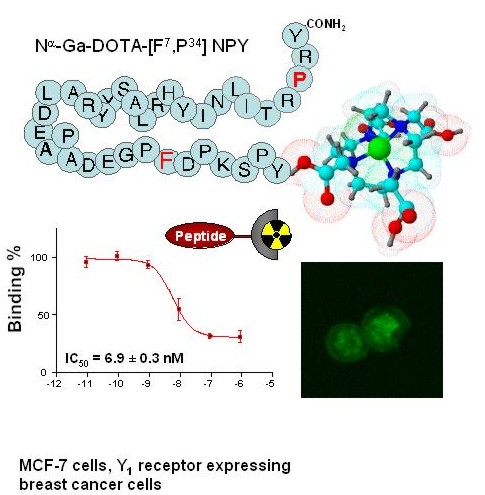
Abb.: Das Y1-Rezeptor selektive NPY-Analogon Na-Ga-DOTA[F7,P34] NPY bindet mit 6.9 nM Affinität an MCF7-Brusttumorzellen und wird spezifisch aufgenommen. Organometall-Peptidkomplexe sollen von potenten Liganden des Neuropeptids Y (NPY) und von Orexin (Ox) hergestellt werden um deren Bedeutung in der Tumordiagnose und Therapie zu untersuchen. Hierfür sollen die Neuropeptidhormone NPY und Orexin mit verschiedenen Chelatoren durch Festphasenpeptidsynthese hergestellt und in der ersten Phase mit Re(CO)3(H2O)3 (nicht-radioaktives Metall mit ähnlichen Eigenschaften wie 99mTc) und Ga(NO3)3 (nicht-radioaktives Isotop) komplexiert werden. Variiert werden soll dabei die Position des Chelators und der Chelator selbst. Die Komplexbildung mit NPY-, bzw. Orexin-Analoga soll in Abhängigkeit von der Länge des Peptides, der Position des Chelators und der Natur des Chelators optimiert werden. Neben der biologischen Aktivität der Peptid-Metallkomplexe, sollen deren Internalisierung in die Zelle, deren Stabilität in der Zelle und deren pharmakokinetische Eigenschaften untersucht und optimiert werden. Interessant ist hierbei vor allem, ob der Metallkomplex unter physiologischen Bedingungen und in der Zelle stabil ist. Ausgewählte Verbindungen sollen in Kooperationen radioaktiv markiert und in Tiermodellstudien eingesetzt werden, um Stabilität, Bioverfügbarkeit und Selektivität in vivo zu charakterisieren. Prof. Dr. Ronald Gust (FU Berlin)Optimierung auf Metallen basierender Wirkkomponenten für Tumortherapeutika
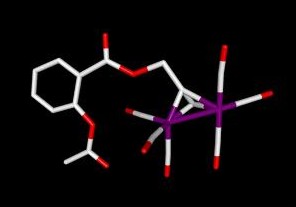
Im Rahmen dieses Teilprojektes werden neue pharmakologisch aktive Wirkkompomenten metallorganischer Verbindungen untersucht und entwickelt. Metallkomplexe können - basierend auf ihrer besonderen Geometrie und Kinetik - in Zellen und anderen biologischen Systemen Reaktionen eingehen, die mit „normalen“ organischen Substanzen nicht realisierbar sind. Diese Eigenschaft macht Bioorganometallverbindungen zu interessanten Kandidaten in der Wirkstofforschung. So werden in diesem Projekt beispielsweise Hexacarbonyldicobalt-Komplexe als neuartige antitumorwirksame Cyclooxygenase-Hemmstoffe und hormonell aktive Substanzen weiterentwickelt. Die Abbildung zeigt ein Hexacarbonyldicobalt-Derivat der Acetysalicylsäure („Aspirin“), welches die Aktivität der biologischen Zielstruktur (Cyclooxygenase) stärker hemmt als die „Muttersubstanz Aspirin“ selbst. Neueste Ergebnisse weisen darauf hin, dass diese Leitstruktur nicht nur antiproliferative Effekte ausöst sondern auch die Angiogenese und die Matrixmetalloproteinase-7 hemmt. Weitere Untersuchungen beinhalten die Entwicklung von Metall-Salen-Komplexen als redoxaktive Tumortherapeutika und Hemmstoffe des Enzyms Thioredoxin-Reduktase. Für diese neuartige Zytostatikaklasse konnte in diversen in-vitro Modellen eine stärkere Hemmung des Tumorzellwachstums festgestellt werden als mit dem etablierten „Metallzytostatikum“ Cisplatin. Der Wirkungsmechanismus dieser Verbindungklasse beinhaltet die Aktivierung reaktiver Sauerstoffspezies (ROS) sowie verstärktes PARP-cleavage und Apoptoseinduktion. Prof. Dr. Eric Meggers (Universität Marburg)Oktaedrische Iridiumverbindungen als Proteinkinase-Inhibitoren
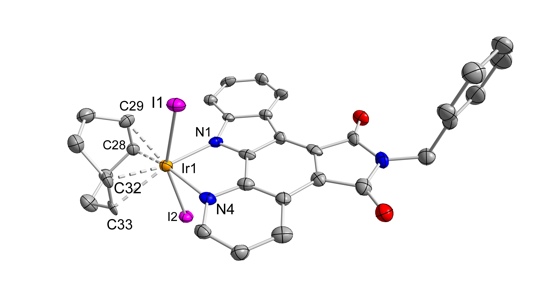
Protein kinases are implicated in many aspects of tumorigenesis and thus protein kinase inhibitors have arisen as a major therapeutic class of compounds for the treatment of cancer. This project deals with the design of inert octahedral Ir(III)-complexes as scaffolds for protein kinase inhibitors. The project is based on the hypothesis that octahedral metal coordination geometries offer new gateways to design rigid, globular molecules with defined shapes that can fill protein pockets in a unique fashion. We envisioned that iridium(III) complexes can be interesting scaffolds for two reasons: Firstly, coordinative bonds with Ir(III) tend to be very inert and therefore Ir(III) complexes should be able to serve as stable scaffolds for the design of enzyme inhibitors. Secondly, octahedral Ir(III) complexes can be accessed from square planar Ir(I) complexes by stereospecific oxidative addition reactions. This provides a powerful tool to control the stereochemistry of octahedral Ir(III) complexes. Longterm goal is the development of substitutionally-inert octahedral organoiridium complexes as novel anticancer agents. Prof. Dr. Ingo Ott (TU Braunschweig)Entwicklung neuer auf Metallen basierender Zytostatika Im Rahmen dieses Teilprojektes, das an zwei Standorten (Berlin und Braunschweig) angesiedelt ist, werden neue pharmakologisch aktive Wirkkompomenten metallorganischer Verbindungen untersucht und entwickelt. Metallkomplexe können - basierend auf ihrer besonderen Geometrie und Kinetik - in Zellen und anderen biologischen Systemen Reaktionen eingehen, die mit „normalen“ organischen Substanzen nicht realisierbar sind. Diese Eigenschaft macht Bioorganometallverbindungen zu interessanten Kandidaten in der Wirkstofforschung. Im Vordergund der aktuellen Arbeiten steht die intensivierte biologische Charakterisierung und Strukturoptimierung von diversen in der ersten Phase des Projektes entwickelten Bioorganometallverbindungen. Dies sind insbesondere metallbasierte NSAR (Nichtsteroidale Antirheumatika), hormonell aktive Metallkomplexe sowie Goldverbindungen als Hemmstoffe der Thioredoxin-Reduktase. Ein weiterer Schwerpunkt dieses Teilprojektes ist die Bioanalytik von Metallwirkstoffen hinsichtlich Stabilität, Zellaufnahme und Bioverteilung in-vitro und in vivo. Dafür stehen diverse instrumentell analytische Methoden zur Verfügung (u.a. HR-CS-AAS, HPLC, CE etc.). Prof. Dr. Ulrich Schatzschneider (Universität Würzburg)Zytotoxizität von Metallcarbonyl-Komplexen mit und ohne Photoaktivierung Since the identification of nitric oxide (NO) as the endothelial cell-derived relaxing factor (EDRF), which was honored with the Nobel price in Physiology to Furchgott, Ignarro, and Murad in 1998, there is a steadily growing interest in the role of small molecules as biological effectors. Although historically preceding the discovery of NO, interest in the role of carbon monoxide (CO) as a biological messenger molecule is on the rise only rather recently.
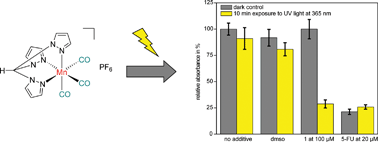
We are thus interested in the preparation of novel CORMs which liberate CO upon irradiation with UV or visible light. CO release by these compounds is studied in a wavelength-dependent manner using the myoglobin assay for fast screening. For interesting complexes, we then proceed to study their cellular uptake properties and differential cytotoxicity in the dark and upon irradiation on a number of cancer cells lines. Spectroscopic studies as well as theoretical calculations are used to understand the primary processes leading to CO release and develop strategies towards compounds with improved properties. For our latest results on a manganese tricarbonyl-based CORM see: J. Niesel, U. Schatzschneider et al. Chem. Commun. (2008), 1798-1800. Prof. Dr. Hans-Günther Schmalz (Universität Köln)Übergangsmetall-komplexierte Naturstoffderivate: Synthese und biologische Evaluierung metallhaltiger Nucleosidanaloga, Aminosäurederivate und Analoga anderer relevanter Naturstoffe als potentielle Tumortherapeutika
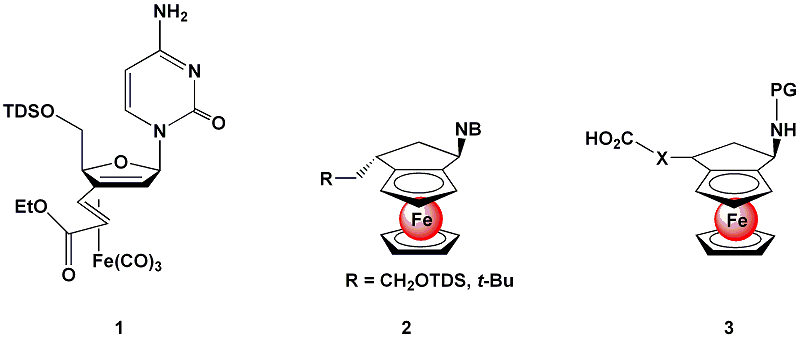
Iron-containing nucleoside analogs such as 1 strongly induce apoptosis in various, even highly resistant cell lines, while the metal-free compounds have no significant biological effect. To explore the mechanism of action and further define a possible molecular target, we have synthesized labeled derivatives of 1. To learn more about the role of the iron fragment we also synthesized structural variants such as the more stable ferrocene-derived nucleosides 2, which were shown to posses a similar apoptosis-inducing potential as 1. By modifying the synthetic strategy, iron-containing amino acid building blocks of type 3 were prepared sucessfully and could be build into several peptidesequences. First biological testing seems promising.
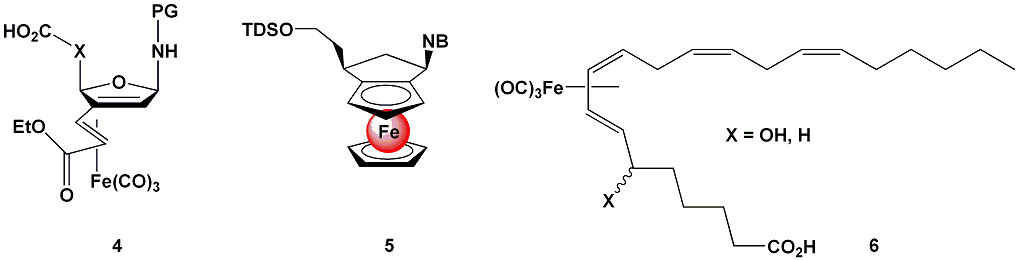
New projects concern the synthesis of iron-carbonyl containing amino acid building blocks like 4, by using the established synthesis, the preparing of cis-configured ferrocene-containing nucleosides of type 5 and adoption of the ferrocene chemistry in order to make RuCp2-containing amino acids and nucleosides. Another field of research is the total synthesis of iron-containing analogs of arachidonic acid (AA) metabolits such as 5-, 8-, 12- and 15-HETE. These compounds (e.g. 6) may selectivly affect lipoxygenase, a class of Fe(III) redox enzymes converting AA into powerful local mediators associated with various diseases including cancer. Prof. Dr. William S. Sheldrick (Universität Bochum)Design und Struktur-Wirkungsbeziehungen von cytotoxischen Rhodium(III)- und Iridium(III)-Komplexen Durch die Ausarbeitung von Struktur-Wirkungs-Beziehungen konnten die von uns inzwischen patentierten Polypyridylkomplexe des Typs mer-[RhCl3(DMSO)(pp)] als optimierte Vertreter einer neuartigen Klasse von Antitumormitteln etabliert werden. Inkubation von Tumorzellen mit den Komplexen führt rasch zu einem dramatischen Absenken des Sauerstoffverbrauchs der Zellen und induziert den intrinsischen Apoptose-Mechanismus der Mitochondria. In ex vivo Untersuchungen zeigen die Komplexe eine wesentlich höhere Aktivität gegenüber Leukämie-Zellen als herkömmliche Wirkstoffe wie Daunorubicin oder Vinchristine.
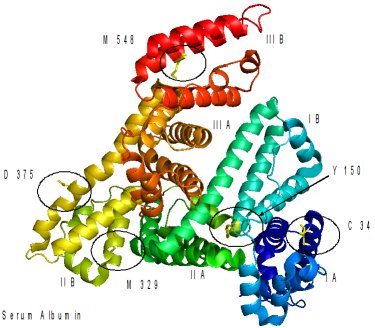
Abb.: Bindungsstellen des Cisplatins in dem Serumprotein Transferrin (Trfe) Um die Apoptose-Induktion genau zu verstehen, ist es notwendig, mögliche Proteintargets in der Tumorzelle zu identifizieren. Zu diesem Zweck haben wir gezeigt, dass die Proteintargets von Metallkomplexen im humanen Blutserum bzw. in lebenden Zellen durch die Verwendung von Trenn- und Sequenzierungstechniken der modernen biomolekularen Massenspektrometrie LC2/MS2 ermittelt werden können. Zum Beispiel konnten DNA-Reparaturproteine als Targets des Antitumormittels Cisplatin in E. coli-Zellen identifiziert werden. Die Abbildung zeigt die Bindungsstellen des Cisplatins in dem Serumprotein Transferrin, das eine Transportrolle für den Komplex nach seiner intravenösen Verabreichung übernehmen kann. Dr. Dr. Aram Prokop (Köln) / Prof. Dr. Stefan Wölfl (Universität Heidelberg)Wirkstoffprüfung und Targetidentifizierung von neuartigen organometallischen Verbindungen und präklinische Evaluation für die Therapie maligner Erkrankungen im Kindesalter
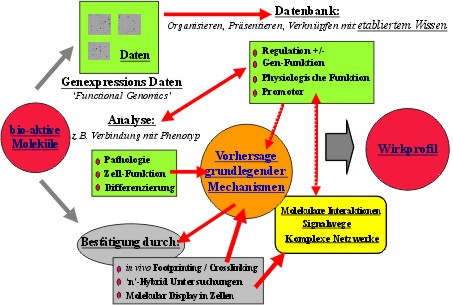
Abb.: Wirkprofile zur Charakterisierung bio-aktiver Moleküle: Integration von Methoden der Funktionellen Genomanalyse mit molekularen, zellbiologischen Methoden für die Analyse der biologischen Aktivität von Wirkstoffen („bio-aktiven Molekülen“) und Beschreibung der Aktivität in Form von Wirkprofilen. Im Rahmen des Teilprojektes Wirkstoffprüfung und Targetidentifizierung werden zelluläre Testsysteme genutzt, um die biologischen Wirkungen organometallischer und bioanorganischer Verbindungen (aus den anderen Teilprojekten) zu erfassen. Dazu werden in verschiedenen biologischen Testsystemen die Wirkungen der neuen Verbindungen im Vergleich mit bekannten Referenzsubstanzen qualitativ und quantitativ untersucht. Durch den einsatz verschiedener zellulärer Testsysteme und molekulargenetischer Methoden sollen zelluläre Wirkmechanismen erfasst und soweit mögliche molekulare Wirkungen identifiziert werden. Alle Verbindungen werden an einer Reihe ausgewählter Zellkultursysteme auf toxische Eigenschaften, insbesondere Cytotoxizität getestet. Durch den Einsatz verschiedener Säugerzellkultursyteme und Zellkulturbedingungen sollen neben einer generellen Cytotoxizität unterschiedliche Organspezifität und ungewöhnliche Wirksamkeitsverläufe erfasst werden. Zusätzlich wird ein Hefebiosensor für die routinemässige Differenierung zwischen Genotoxizität und Zytotoxizität genutzt. Zur detailierteren Erfassung der biologischen Wirkung werden weiterführende Methoden der Bioanalytik und Funktionellen Genomanalyse wie die Erfassung von Genexpressionsprofilen, der Aktivierung wichtiger zellulärer Signalwege genutzt. In Ergänzung dazu kann auf verschiedene weitere Methoden der Funktionellen Genom und Proteomanalyse zurückgegriffen werden, wie z.B. Gendeletion und Erfassung von Protein-Protein-Nukleinsäure-Interaktionen, die eine Erfassung und Bestätigung molekularer Wirkungen und Wirkorte ermöglichen. |